Primaire structuur (eiwitten)


De primaire eiwitstructuur is de lineaire sequentie van aminozuren in een eiwit of peptide.[1] De primaire structuur van een eiwit is opgebouwd uit een onvertakte keten die begint bij de N-terminus (het uiteinde met de aminogroep), en eindigt bij de C-terminus (het uiteinde met de carboxygroep). Tijdens de eiwitsynthese worden vrije aminozuren op deze wijze in een specifieke volgorde aan elkaar verbonden. Deze volgorde noemt men ook wel de aminozuursequentie. De primaire structuur is uiteindelijk verantwoordelijk voor de eigenschappen van het eiwit en bevat de informatie die bepaalt hoe het eiwitmolecuul zich ruimtelijk kan opvouwen.[2]
Moleculen die uit aminozuren bestaan en onderling verbonden zijn door peptidebindingen, worden peptiden genoemd. Gaat het om minder dan twintig aminozuren, dan spreekt men van oligopeptiden. Als een molecuul uit twintig tot honderd aminozuren is opgebouwd, noemt men het molecuul een polypeptide.[2] In biologische systemen worden polypeptiden aangemaakt in ribosomen (translatie). De primaire eiwitstructuur kan vastgesteld worden door middel van eiwitsequencing, of afgeleid worden uit DNA-sequenties.
Vorming
[bewerken | brontekst bewerken]Biologisch
[bewerken | brontekst bewerken]Aminozuren kunnen door hun tweezijdige structuur (hun aminogroep en zuurgroep) polymeriseren tot lange ketens. Elk aminozuur in de keten, elk residu, is met de ander verbonden door middel van een peptidebinding. In levende organismen worden aminozuren via peptidebindingen aan elkaar gekoppeld tijdens de translatie: het proces van eiwitsynthese. De translatie vindt plaats in ribosomen, kleine molecuulcomplexen die voorkomen in het cytoplasma. Sommige organismen zijn in staat om korte peptiden te synthetiseren buiten ribosomen, vaak door gebruikmaking van andere aminozuren dan de twintig proteïnogene. Deze peptiden kunnen cyclisch of cross-linked zijn en kennen vaak talrijke modificaties.
Chemisch
[bewerken | brontekst bewerken]Peptiden kunnen ook chemisch gesynthetiseerd worden. Hiervoor zijn een breed scala aan laboratoriumtechnieken beschikbaar. Bij chemische synthese worden de aminozuren vaak in de tegenovergestelde volgorde verbonden dan bij biologische eiwitsynthese: ze beginnen namelijk bij de C-terminus. Het chemisch synthetiseren van lange polypeptiden is economisch gezien onrendabel. Hiervoor maakt men gebruik van biotechnologische toepassingen, zoals het kweken van transgene prokaryoten.
Notatie
[bewerken | brontekst bewerken]Een eiwitsequentie wordt meestal genoteerd door middel van een reeks letters, waarbij elke letter een aminozuur vertegenwoordigt. De reeks begint bij het N-terminale uiteinde en loopt door tot het C-terminale uiteinde. De twintig natuurlijk voorkomende aminozuren kennen naast een eenletterige code ook een drieletterige code, zoals in de tabel hieronder is weergegeven. Net als bij nucleïnezuursequenties zijn er ook letters die een zogenaamd ambigu aminozuur aanduiden: hierbij is men niet zeker om welk aminozuur het precies gaat.[1][3][4]
| Aminozuur | 3-letter[5] | 1-letter[5] |
|---|---|---|
| Alanine | Ala | A |
| Arginine | Arg | R |
| Asparagine | Asn | N |
| Asparaginezuur | Asp | D |
| Cysteïne | Cys | C |
| Glutaminezuur | Glu | E |
| Glutamine | Gln | Q |
| Glycine | Gly | G |
| Histidine | His | H |
| Isoleucine | Ile | I |
| Leucine | Leu | L |
| Lysine | Lys | K |
| Methionine | Met | M |
| Fenylalanine | Phe | F |
| Proline | Pro | P |
| Serine | Ser | S |
| Threonine | Thr | T |
| Tryptofaan | Trp | W |
| Tyrosine | Tyr | Y |
| Valine | Val | V |
| Symbool | Beschrijving | Betreffende residuen |
|---|---|---|
| X | Elk aminozuur, onbekend | Allemaal |
| B | Aspartaat of asparagine | D, N |
| Z | Glutamaat of glutamine | E, Q |
| J | Leucine of isoleucine | I, L |
| Φ | Hydrofoob | V, I, L, F, W, M |
| Ω | Aromatisch | F, W, Y, H |
| Ψ | Alifatisch | V, I, L, M |
| π | Klein | P, G, A, S |
| ζ | Hydrofiel | S, T, H, N, Q, E, D, K, R, Y |
| + | Positief geladen (basisch) | K, R, H |
| – | Negatief geladen (zuur) | D, E |
Modificaties
[bewerken | brontekst bewerken]Polypeptiden zijn onvertakte polymeren, dus de primaire structuur kan eenvoudig worden bepaald door alle aminozuren langs de ruggengraat vast te stellen. Het is echter mogelijk dat de polypeptideketen onderling crosslinks vormt door middel van zwavelbruggen (covalente bindingen tussen cysteïnes). In de primaire structuur ligt ook vast waar deze zwavelbruggen voorkomen.
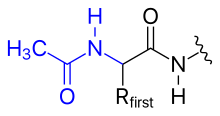
Eiwitten ondergaan meestal posttranslationele modificaties, een proces waarin de primaire structuur wordt gemodificeerd door binding van een functionele groep of andere covalente wijziging. De N-terminus van een polypeptide kan de volgende modificaties ondergaan: acetylering, formylering of myristoylering (binding van een vetzuurstaart voor verankering in membranen). De C-terminus kan ook gemodificeerd worden, bijvoorbeeld door aminering. Ook de zijketens van de aminozuurresiduen worden gemodificeerd: fosforylering, glycosylering, methylering, hydroxylering en ubiquitinering zijn belangrijke voorbeelden.[6][7]
Isomerisatie
[bewerken | brontekst bewerken]De chirale centra van een polypeptideketen kunnen racemisatie ondergaan. Ondanks dat de aminozuursequentie daarbij niet verandert, heeft dit wel invloed op de chemische eigenschappen van het polypeptide. L-aminozuren die van nature voorkomen in eiwitten kunnen spontaan isomeriseren tot D-aminozuren via hun -atoom. Wanneer dit gebeurt, kunnen proteasen de geracemiseerde keten meestal niet meer splitsen.[6]
Zie ook
[bewerken | brontekst bewerken]Referenties
- ↑ a b (en) Sanger, F. (1952). The arrangement of amino acids in proteins, 1–67. ISBN 9780120342075.
- ↑ a b Schuit, F.C (2000). Medische biochemie. Bohn Stafleu Van Loghum, Houten, "Hoofdstuk 2: De primaire eiwitstructuur", 31–49. ISBN 9031330205.
- ↑ (en) Aasland R, Abrams C, Ampe C, Ball L. (2002). Normalization of nomenclature for peptide motifs as ligands of modular protein domains. FEBS Letters 513 (1): 141–144. ISSN: 1873-3468. DOI: 10.1016/S0014-5793(01)03295-1.
- ↑ (en) Aasland R, Abrams C, Ampe C, Ball LJ, Bedford MT. (1968). A One-Letter Notation for Amino Acid Sequences. European Journal of Biochemistry 5 (2): 151–153. ISSN: 1432-1033. PMID 11911894. DOI: 10.1111/j.1432-1033.1968.tb00350.x.
- ↑ a b (en) Hausman, Robert E. & Cooper, Geoffrey M. (2004). The cell: a molecular approach. ASM Press, Washington, D.C, p. 51. ISBN 978-0-87893-214-6.
- ↑ a b (en) Voet, D.; Voet, J. G. & Pratt, C. W. (2013). Fundamentals of Biochemistry: Life at the Molecular Level, 4th. John Wiley & Sons, Hoboken, NJ. ISBN 0470547847.
- ↑ (en) Khoury GA, Baliban RC, Floudas CA (2011). Proteome-wide post-translational modification statistics: frequency analysis and curation of the swiss-prot database. Scientific Reports 1: 90. PMID 22034591. PMC 3201773. DOI: 10.1038/srep00090.
Literatuur
- Ampe, C. & Devreese, B. (2012). Algemene biochemie. Uitgeverij Acco, Leuven. ISBN 978-90-334-8988-4.
- (en) Berg, J. (2015). Biochemistry, 8th edition. W. H. Freeman and Company, New York, "Chapter 2: Protein composition and structure". ISBN 978-1-4641-2610-9.

